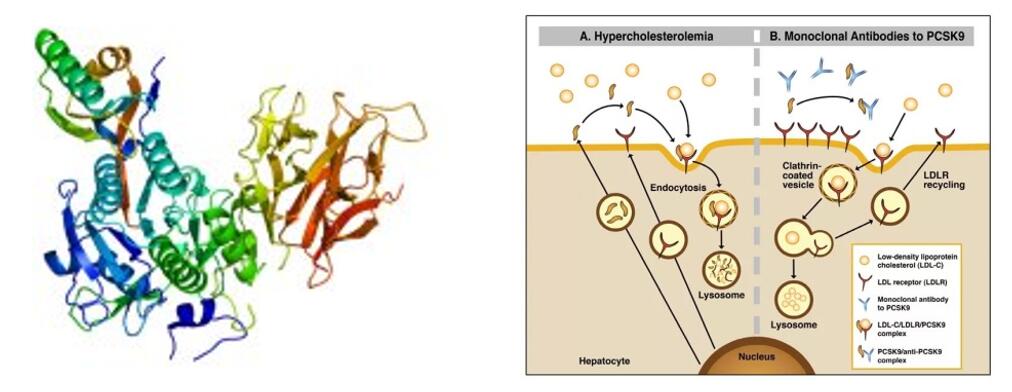
Gần đây, Cục Quản lý Thực phẩm và Dược phẩm Nhà nước Trung Quốc (SFDA) đã chính thức chấp thuận đơn đăng ký lưu hành cho tafolecimab (kháng thể đơn dòng PCSK-9 do INNOVENT BIOLOGICS, INC) sản xuất để điều trị tăng cholesterol máu nguyên phát (bao gồm tăng cholesterol máu gia đình dị hợp tử và tăng cholesterol máu không do gia đình) và rối loạn lipid máu hỗn hợp. Đây là chất ức chế PCSK-9 tự sản xuất đầu tiên được đăng ký lưu hành tại Trung Quốc.
Tafolecimab là một loại thuốc sinh học cải tiến được phát triển độc lập bởi INNOVENT BIOLOGICS, INC. Kháng thể đơn dòng IgG2 của người liên kết đặc hiệu với PCSK-9 để tăng mức LDLR bằng cách giảm nội bào qua trung gian PCSK-9, do đó tăng đào thải LDL-C và giảm mức LDL-C.
Trong những năm gần đây, tỷ lệ rối loạn lipid máu đã tăng đáng kể ở Trung Quốc. Tỷ lệ rối loạn lipid máu và tăng cholesterol máu ở người trưởng thành lần lượt là 40,4% và 26,3%. Theo báo cáo năm 2020 về Sức khỏe và Bệnh tim mạch tại Trung Quốc, tỷ lệ điều trị và kiểm soát rối loạn lipid máu ở người trưởng thành vẫn còn thấp, và tỷ lệ tuân thủ điều trị LDL-C của bệnh nhân rối loạn lipid máu thậm chí còn kém hơn.
Trước đây, statin là phương pháp điều trị chính cho bệnh tăng cholesterol máu ở Trung Quốc, nhưng nhiều bệnh nhân vẫn không đạt được mục tiêu giảm LDL-C sau khi điều trị. Việc tiếp thị PCSK-9 đã mang lại hiệu quả tốt hơn cho bệnh nhân.
Việc nộp đơn xin cấp phép tafolecimab từ INNOVENT BIOLOGICS, INC dựa trên kết quả của ba thử nghiệm lâm sàng được đăng ký theo hình thức dân chủ. Thuốc có hồ sơ an toàn tổng thể tốt, tương tự các đặc điểm an toàn của các sản phẩm đã được bán trên thị trường, và đạt được khoảng cách sử dụng dài (mỗi 6 tuần). Kết quả của nghiên cứu CREDIT-2 đã được Hội nghị thường niên năm 2022 của Hội Tim mạch Hoa Kỳ (ACC) chấp nhận dưới dạng tóm tắt và được công bố trực tuyến.
Nếu đơn xin được chấp thuận, nó sẽ phá vỡ thế bế tắc của việc tiêm PCSK-9, Trung Quốc sẽ trở thành quốc gia thứ tư có PCSK-9 sau Hoa Kỳ (Amgen), Pháp (Sanofi) và Thụy Sĩ (Novartis).
Thời gian đăng: 04-07-2022