中国国家食品医薬品局(SFDA)は先日、原発性高コレステロール血症(ヘテロ接合性家族性高コレステロール血症および非家族性高コレステロール血症を含む)および混合型脂質異常症の治療薬として、タフォレシマブ(INNOVENT BIOLOGICS,INC.製、PCSK-9モノクローナル抗体)の販売申請を正式に受理しました。これは、中国で販売申請された初の自社製造PCSK-9阻害剤となります。
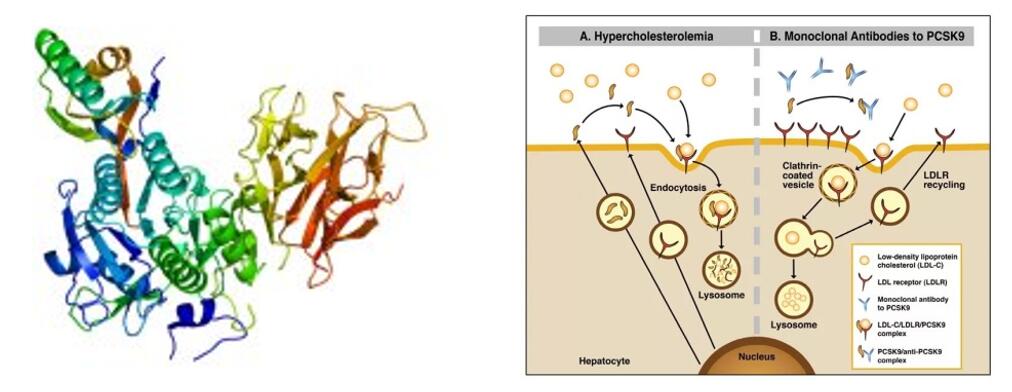
タフォレシマブは、INNOVENT BIOLOGICS, INC. が独自に開発した革新的な生物学的医薬品です。IgG2 ヒトモノクローナル抗体は PCSK-9 に特異的に結合し、PCSK-9 を介したエンドサイトーシスを減らすことで LDLR レベルを上昇させ、LDL-C の排出を増加させて LDL-C レベルを低下させます。
近年、中国では脂質異常症の有病率が著しく増加しており、成人における脂質異常症と高コレステロール血症の有病率はそれぞれ40.4%と26.3%と高くなっています。2020年の「中国における心血管の健康と疾患に関する報告書」によると、成人における脂質異常症の治療とコントロール率は依然として低く、脂質異常症患者のLDL-C値遵守率はさらに低い状況にあります。
中国ではこれまで、高コレステロール血症の主な治療薬はスタチンでしたが、多くの患者が治療後もLDL-C値の低下という治療目標を達成できませんでした。PCSK-9の発売により、患者にとってより優れた治療効果がもたらされました。
INNOVENT BIOLOGICS, INC.によるタフォレシマブの申請は、民主的な段階で登録された3つの臨床試験の結果に基づいています。タフォレシマブは、市販薬の安全性特性と同様に良好な全体的な安全性プロファイルを有し、長期間(6週間ごと)の投与間隔を実現しています。CREDIT-2試験の結果は、2022年米国心臓病学会(ACC)年次総会で抄録として採択され、オンラインで公開されました。
この申請が承認されれば、PCSK-9の輸入をめぐる行き詰まりが打破され、中国は米国(アムジェン)、フランス(サノフィ)、スイス(ノバルティス)に続き、PCSK-9を導入する4番目の国となる。
投稿日時: 2022年7月4日