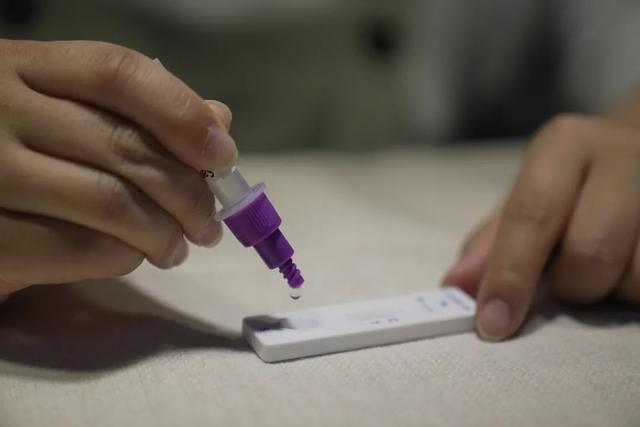
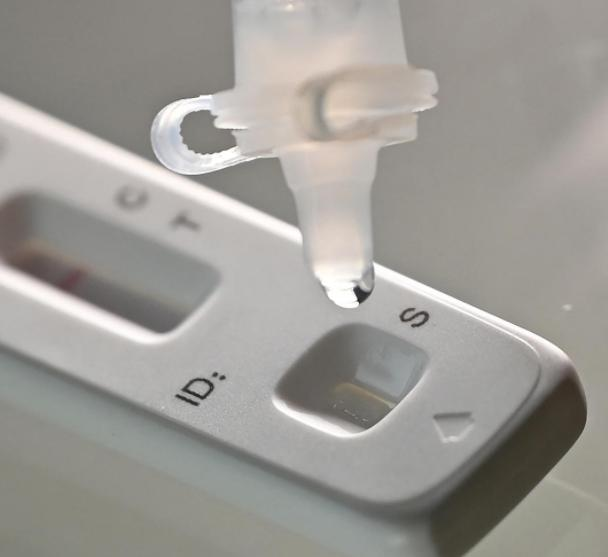
Den 12 marsth 2022, deNMPA (SFDA) utfärdade ett meddelande om godkännande av ändringen av ansökan om självtestning av COVID-19-antigenprodukter av Nanjing Vazyme BiotechAB, Peking Jinwofu bioteknikteknikAB, Shenzhen Huada Yinyuan Pharmaceutical Technology Co, Ltd, Guangzhou Wondfo Biotech Co., Ltd. ochBEijing Savant Biotechnology Co., Ltd.(Huaketai)Fem produkter för självtestning av COVID-19-antigen har lanserats.
Den 11 mars 2022 tillkännagav NHC att, för att ytterligare optimera teststrategin för det nya coronaviruset och tillgodose behoven av förebyggande och kontroll av COVID-19, beslutade den omfattande gruppen inom statsrådets gemensamma förebyggande och kontrollmekanism att lägga till antigentestning till nukleinsyratestning och utarbetade "tillämpningsprotokollet för detektion av antigen för det nya coronaviruset (prövning)"
Protokollet specificerar den tillämpliga populationen för antigentestning:
Först, de som besöker primärvårdsinrättningar och har symtom som luftvägsinfektion och feber inom 5 dagar efter symtomdebut;
För det andra, personal för karantänobservation, inklusive observation vid hemkarantän, nära kontakt och subnära kontakt, observation vid inträdeskarantän, personal i inneslutningsområden och kontrollområden;
Den tredje är invånarna i samhället som har behov av egendetektering av antigen.
Tips: Antigendetektion är ett viktigt komplement till nukleinsyradetektion, men resultaten av antigen-självdetektion kan inte användas som grund för diagnos av infektion.
Publiceringstid: 22 mars 2022