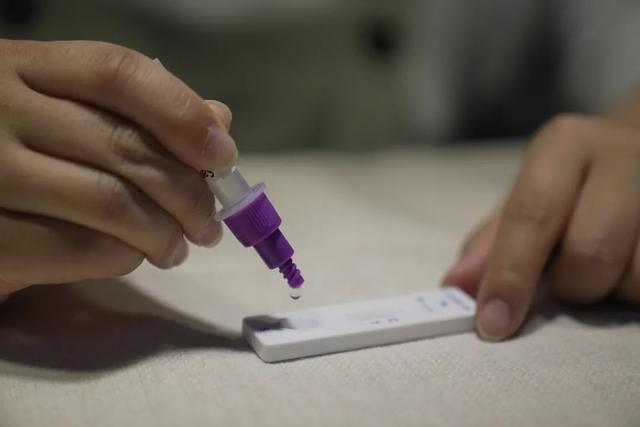
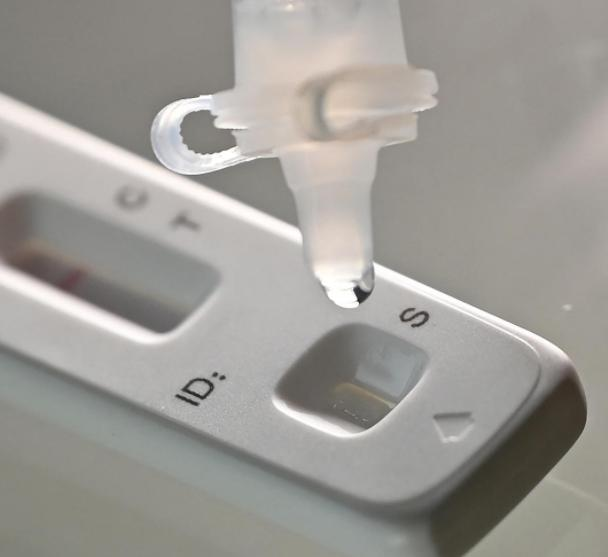
3月12日th 2022年、 そのNMPA(SFDA) 南京Vazyme BiotechによるCOVID-19抗原製品の自己検査の申請変更を承認する通知を発行しました株式会社北京金沃富バイオエンジニアリングテクノロジー株式会社, 深セン華大銀源製薬テクノロジー株式会社, 広州ウォンドフォバイオテクノロジー株式会社 そしてBエイジン・サヴァント・バイオテクノロジー株式会社(華keタイ)COVID-19抗原自己検査製品5種類が発売されました。
2022年3月11日、国家衛生健康委員会は、新型コロナウイルスの検査戦略をさらに最適化し、COVID-19の予防と制御のニーズに応えるために、国務院の合同予防と制御メカニズムの総合チームが核酸検査に加えて抗原検査を追加し、「新型コロナウイルス抗原検出の申請プロトコル(試行)」を作成したと発表した。
プロトコルでは、抗原検査の対象となる集団を以下のように規定しています。
まず、発症後5日以内に呼吸器症状や発熱等の症状があり、一次医療機関を受診した方。
二、検疫観察人員には、自宅検疫観察人員、濃厚接触者および準濃厚接触者、入国検疫観察人員、封じ込め区域および管理区域の人員が含まれます。
3つ目は、抗原自己検出のニーズを持つ地域住民です。
ヒント:抗原検出は核酸検出の重要な補足ですが、抗原自己検出の結果を感染診断の基礎として使用することはできません。
投稿日時: 2022年3月22日